Lors de mon précédent article sur le tableau périodique de la physique classique que je vous avais présenté, je vous avais dit que je souhaitais approfondir mes recherches sur ce monument de science réalisé par Mendeleïev et bien aujourd’hui, nous allons attaquer la version quantifiée (de la physique des quantas).

Accrochez-vous parce que ce n’est pas si intuitif et il y’a des termes à approfondir dans un premier temps, en voici une liste.
5/ Nombre quantique secondaire L (Bloc)
6/ Nombre quantique magnétique ml
7/ Nombre quantique magnétique ms
Je vous ai préparé un tableau qui essaie de représenter ces concepts plus visuellement que ce que l’on trouve sur Wikipédia.
Ce qu’on remarque en premier lieu comparé au tableau de physique classique c’est que nous avons deux fois moins de cases. Les éléments ne sont plus représentés mais laissent place à des couches et des sous-couches électroniques.
Essayez de zoomer ou de télécharger mon tableau pour le comprendre.
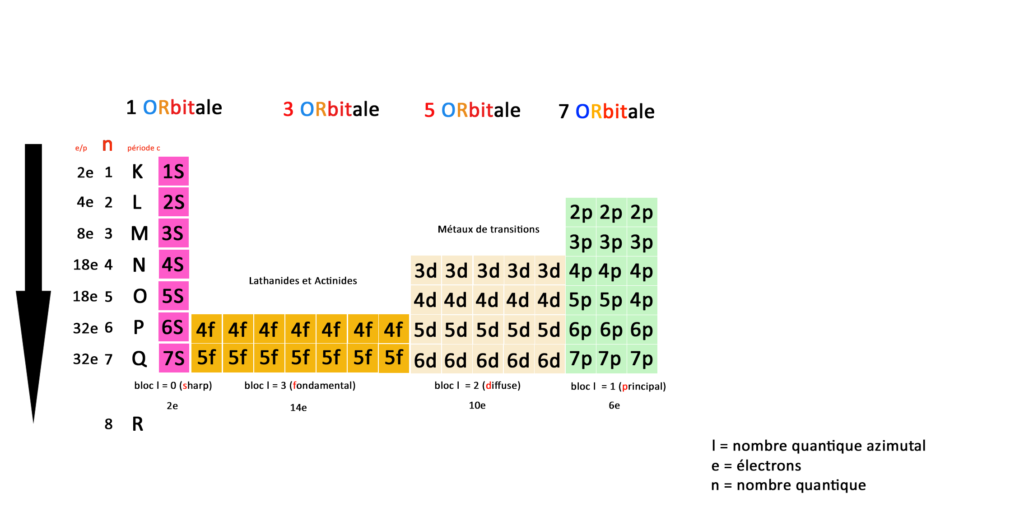
Nous n’avons donc plus 118 éléments mais une correspondance entre orbitales, couches, sous-couches et blocs définies par 59 cases : une case est une sous-couche, une couche est une ligne ou période.
Les couches sont représentées par le nombre quantique N qu’on peut aussi appeler période ; pour essayer de réconcilier le tableau de la physique classique et le tableau de la physique quantique. C’est ce que j’ai essayé de faire dans ce tableau.
Le nombre quantique N représente l’énergie de l’électron en fonction de sa place sur l’orbital, le nombre quantique L représente le moment angulaire de l’électron c’est à dire sa position sur l’orbital.
D’autre part les blocs (en bas sur mon tableau) sont représentés par le nombre quantique secondaire L dit azimutal : 0 ≤ ℓ ≤ n – 1. Cela vient du terme en astronomie azimut.
Révisons un petit peu le tableau périodique classique :
Tableau périodique classique :
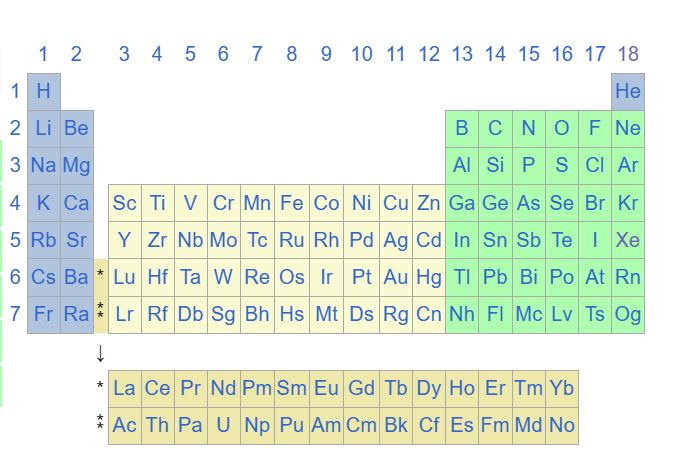
Tableau périodique quantique :

Comme je l’ai déjà écrit nous n’avons donc plus 118 éléments mais une correspondance entre orbitales, couches, sous-couches et blocs définies par 59 cases.
N est le nombre quantique qui représente le nombre de couches électroniques de l’atome, la période c dite classique reprend les couches du tableau périodique classique.
A gauche vous avez le nombre d’électrons total par période, blocs, orbitales, couches et sous-couches, En quantique on fonctionne toujours par pair, la première sous-couche 1S(harp) compte 2 électrons.
Prenons la deuxième couche, elle compte 4 sous-couches 2S(harp) 3 sous couches 2P(rincipal) qui totalisent 8 électrons.
Pour vous expliquer comment les électrons se répartissent parmi ces couches
On va commencer par faire un petit calcul de configuration électronique pour un élément très important en médecine pour prendre la tension cardiaque systolique et diastolique : le Mercure de symbole atomique Hg.
Si on compare les deux tableaux on a un atome de mercure en position 80 (numéro atomique= nombre de charges = nombre d’électrons) en physique classique ce qui correspond à la case 5d(iffuse ) du bloc L2(moment angulaire) pour 5 orbitales dans les métaux dits de transitions.
On sait comme en physique classique que pour calculer la configuration électronique d’un élément chimique, il faut se reporter au gaz stable rare le plus proche en dessous dans le tableau périodique, dans notre cas précis c’est le Xénon.
Le Xénon [Xe] à un numéro atomique de 54 donc nous avons deux solution pour calculer la couche électronique du Mercure Hg
1ère méthode :
On part du Xénon et on va déterminer 80 électrons (mercure)-54 électrons(Xenon) = 36 il nous reste 36 électrons à placer.
Partez maintenant de la sous-couche correspondant à la place du mercure 5d(iffuse) à prendre les 3 sous-couches du Mercure en partant vers la gauche sur le tableau : 4f14+ 5d10 + 6s2 soit (14+10+2) électrons = 36.
54([Xenon])+36 = 80 (numéro atomique, nombre de charges(protons et électrons)).
Pour récapituler la configuration électronique est : [Xenon] 54 + les sous-couches 4f14+5d10+6s2
Mais alors comment repérer les électrons de valence avec cette notation ? : C’est simple ce sont les électrons associés à la couche du numéro atomique N le plus élevé car c’est la couche la plus éloignée du noyau atomique.
Dans notre exemple le Mercure a bien la couche 6s2 de nombre quantique 6 est celui qui va délimiter le nombre d’électrons sur la dernière couche N6 ou de période P = 2.
2ème méthode pour disposer la configuration électronique à partir du tableau quantique, on va utiliser la méthode de Kachlowski reportez-vous bien au tableau pour voir le nombre d’électrons associés à chaque bloc :
On va remplir d’abord la première case du tableau :

La couche 1s(harp) et on sait qu’elle se remplit de 2 électrons.

On va remplir ensuite la couche 2s(harp) et 2p(rincipal)
on sait que la couche 2s(harp) a 2 électrons et on sait que la couche 2p(rincipal) a 6 électrons, ce qui nous fait un total de 8 électrons.
On va ensuite remplir la couches 3s 3p 3d ce qui nous fait 18 électrons.
Ensuite nous avons les couches 4s(harp) 4p(rincipal) 4d(iffuse) 4f(fondamental) qui vont donc se remplir par respectivement par 2,10,6,14 électrons soit : 32 électrons
A ce stade il est important de marquer une pause : nous avons un total de 60 électrons.
On sait que nous avons 2 électrons sur la dernière couche qui peuvent participer à la liaison chimique.
Ensuite on va remplir la couche 5s, 5p, 5d, par 2,10,6 ce qui nous fait encore 18 électrons pour finalement avoir une bonne équivalence en terminant avec la couche 6s2 d’une part à la fois le plus haut nombre quantique : 6 qui détermine le nombre d’électrons de valence : 2.
Voici un autre graphique pour utiliser la méthode pour utiliser la règle de Kachlowski :
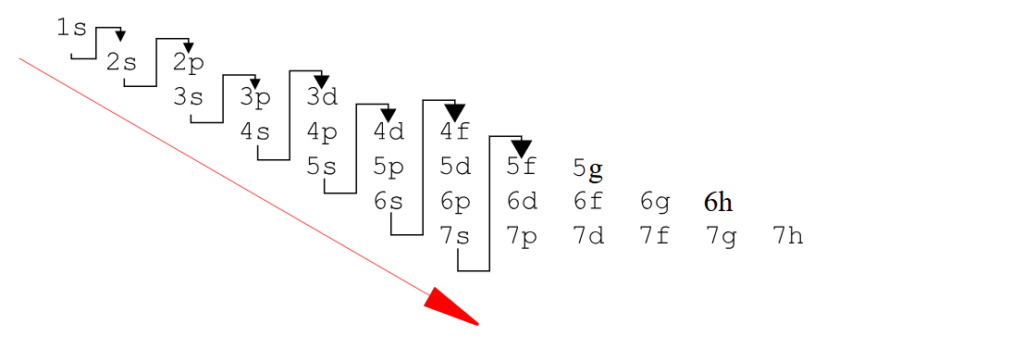
Vous avez compris ? Moi cela m’a pris un peu de temps, cela demande patience et application.
Je reviendrais plus tard compléter l’article en rapport aux orbitales, au nombre quantique magnétique noté ml et le nombre quantique magnétique de spin(rotation de l’électron).
Je vous ai mis les liens au début de l’article, a vous de les approfondir.
Ce qui m’intéresse maintenant c’est de vous détailler les propriétés chimique d’un élément en particulier le Mercure et dans ses moindres caractéristiques.

MERCURE (HG) 80
Note : Mercure est un élément physique de symbole Hg, de numéro atomique 80 (nombre de protons et d’électrons) il est communément appelé Argent rapide (Quicksilver). Mercure est l’unique élément qui est liquide à des conditions standards pour la température et la pression. Le seul autre élément qui est liquide dans ces conditions est le brome.
Il a été découvert par les égyptiens.
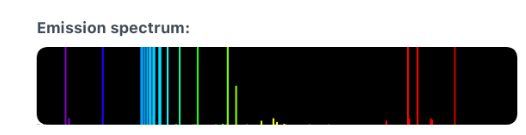
Spectre d’émission : le mercure émet des ondes électromagnétiques donc des ondes de lumière visibles intensément dans le bleu et aussi dans le vert.
Propriétés classiques
Poids Atomique ( Masse atomique relative) : 200.592560642052 (g/mol)
La force de l’attraction terrestre sur l’atome en g/mol
Un petit point par rapport à la mole noté mol, c’est une unité du système international noté SI qui quantifie le nombre de molécules dans une entité et qui est basé sur la constante d’Avogadro. ( En mathématiques une constante est le contraire d’une variable )
Densité absolue : 13.5336 (g/cm3)
Masse par rapport au volume d’un corps
Point de fusion : -38.83°C = 234.32 K = −37.89 °F
Le point de fusion est le point auquel l’élément change de phase en passant de l’état solide à l’état liquide. Il dépend aussi de la pression mesuré en atmosphère ou kPa (kilo pascal)
Point d’ébullition : 356.73°C= 674.11 F° = 629.88 K
Groupe Atomique : IIB
Le mercure (Hg) est un élément chimique classé dans le groupe IIB du tableau périodique, ce qui correspond aujourd’hui au groupe 12 selon la numérotation moderne de l’IUPAC. (chimie appliquée) Historiquement, la notation IIB vient de l’ancienne classification périodique utilisée dans certains pays (notamment les États-Unis), où les groupes étaient divisés en A (éléments représentatifs) et B (éléments de transition).
Valence : I, II 1 ou 2 atomes seulement peuvent participer à des liaisons covalentes.
(Nombre d’électrons sur la couche externe pouvant participer à une liaison chimique)
Période : 6 (couche P dans le tableau)
Block : d-block veut dire diffuse bloc dans le tableau périodique quantique (voir le tableau périodique quantique que j’ai réalisé) En effet il est à la position 5d dans les métaux dits de transition.
L’ion mercure :
L’ion mercure est chargé deux fois Hg2+, je pense que c’est lié à ses deux électrons sur la dernière couche mais à vérifier.
Voici un point sur lequel je vais m’arrêter longuement, on a abordé dans mes précédents articles sur le tableau périodique classique et les différentes représentations moléculaires : les liaisons covalentes ou les électrons sont échangés entre les atomes pour former une molécule tout aussi neutre grâce aux électrons de valence.
Mais ces liaisons covalentes ne sont qu’une partie de la chimie, en effet la plupart des autres composés obéissent à des liaisons électro-ioniques ou les électrons ne sont pas échangés mais transférés par électronégativité.
Voilà qui mérite un article à lui seul mais sachez que les états d’oxydation pour un atome dans un composé ionique peuvent aller de -5 à +9 en passant par 0. Ces états ne veulent pas dire que le composé est chargé électriquement ou négativement mais cela représente une valeur scalaire des atomes d’oxygène ou d’hydrogène dans un composé.
Je décrirai toutes ces règles dans un autre article mais sachez que pour le mercure d’après mon tableau périodique avancé, l’atome Hg peut avoir l’état 0, +1, +2, +4.
Le potentiel d’ionisation est l’énergie qu’il faut induire à l’atome pour expulser un électron et donc créer un déplacement : 10.438 eV(électron volt)
Le rayon de l’atome : 171(picomètre) soit (10^-12)
Le rayon de covalence :138 (picomètre)(10^-12)
Le rayon de covalence est le rayon de la liaison chimique.
Le rayon de Van Der Waals :209(picomètre (10^-12)
Je vous renvoie à la définition si vous voulez approfondir mais ce qu’il faut savoir c’est que c’est la plus petite approche d’un atome par une sphère donc potentiellement un autre atome.

Van Der Waals 1837-1923
Propriétés Electromagnétique
Conductivité électrique : 1040582.72632674 S/m
Exprime la capacité du matériau à conduire les électrons. Réciproque de la résistivité.
L’unité utilisé que je ne connaissais pas est le (S/m) Siemens par mètre Werner Von Siemens est le nom d’un ancien physicien qui s’intéressait de près à la conductivité du mercure.
On comprend mieux pourquoi une marque porte son nom (Note pour moi-même, a expliquer à nos enfants pour les aider à développer leur pensée)

Werner Von Siemens 1816-1892
Type électrique : Conducteur
Il s’agit du point auquel la résistance disparait et le champ magnétique est expulsé. (train Hyperloop) Température proche du zéro absolu.
-269.0°C = -452.2°F = 4.15K
Type Magnétique : Diamagnétisme
Le préfixe dia, veut dire à travers, cela explique pourquoi dans nos anciens sphygmomanomètres le mercure sert à mesurer la pression artérielle systolique et diastolique. Il émet un champ magnétique extérieur opposé ce qui le transforme en instrument de mesure de la pression.

Un tensiomètre électronique fonctionne de manière automatisée, principalement grâce à la méthode oscillométrique.
Susceptibilité Magnétique du volume : -2.84 . 10^-5 (m^3/mol)
Susceptibilité Magnétique de la masse : -2.1 . 10^-9 (m^3/mol)
Susceptibilité Magnétique molaire : -4.21 . 10^-10 (m^3/mol)
Capacité de résistance de l’atome à l’électricité mesuré en Ω . cm :
9.61 par 10^-7 (Ω . m) (lettre grecque Omega)
Propriétés Thermodynamique
Phase : Liquide
Etat de la matière selon des variables standard de température et de pression. Se dit aussi pour des ondes superposés.
L’enthalpie de fusion anciennement appelée la chaleur de fusion est une fonction que je ne connaissais pas mais qui permet de regrouper en une seule équation toutes les variables thermodynamiques d’un matériau. Les trois variables sont l’énergie interne, la pression et le volume.
139.5 (J/kg . K)
La chaleur spécifique est la capacité thermique d’un matériau rapporté à sa masse exprimé en Jouls/kg par Kelvin.
L’expansion thermique est la capacité du matériau à augmenter en longueur, surface ou volume sous l’effet de la chaleur.
60.4 . 10^-6(C°^-1)
59.11 (kJ . mol)
Chaleur pour laquelle le liquide se transforme en vapeur
J’ai toujours pensé que la cristallisation était une des quatre opérations importante de la nature avec l’ionisation, la polymérisation, et la polarisation.
Les paramètres cristallins, aussi appelés paramètres de maille, sont des grandeurs utilisées pour décrire la maille d’un cristal. On distingue trois longueurs (a, b, c) et trois angles (α, β, γ) qui déterminent entièrement le parallélépipède qu’est la maille, élémentaire ou multiple.
Les paramètres a, b et c sont mesurés en Angstrom en nanomètres (nm), parfois en picomètres, et α (alpha), β (Beta) et γ (Gamma) en degrés (°).
L’Angstrom est une unité juste en dessous du nanomètre c’est à dire 10^-10m
1ere phase crystalline
Forme du Crystal : Rhomboèdre

longueurs :
a (hexagonal)=3.464 A c (hexagonal)=6.708 A
Attitude : 1.94
Le mercure peut avoir deux paramètres de maille car il peut exister sous plusieurs phases cristallines, et l’une d’elles peut avoir une maille non cubique, nécessitant deux paramètres pour la décrire (ex. : a et c dans une structure hexagonale).
2ème phase cristalline
Forme du Crystal :
Le cube corps centré

Propriétés :
a = 3.995 A c = 2.825 A
En thermodynamique et pour la physique des états solides, le modèle de Debye est une méthode développé par Peter Debye pour estimer la contribution du phonon (son) à la chaleur spécifique. Il permet de traiter les vibrations du réseau cristallin de l’atome comme les phonons dans une boite contrastant avec l’effet photoélectrique d’Einstein qui traite du solide comme de nombreux oscillateurs harmoniques quantiques individuels et non interactifs.



Propriétés du matériau
Conductivité Thermique : 8.3 (W/mK)
La mesure qui permet de conduire la chaleur mesuré en Watt par milli (10^-3) Kelvin.
Transmission de la vitesse du son : 1451.4 (m/s)
La vitesse à laquelle le son se propage à l’intérieur du matériau.
Index de Réfraction :1.000933
Modification du chemin de la lumière par son passage dans le matériau
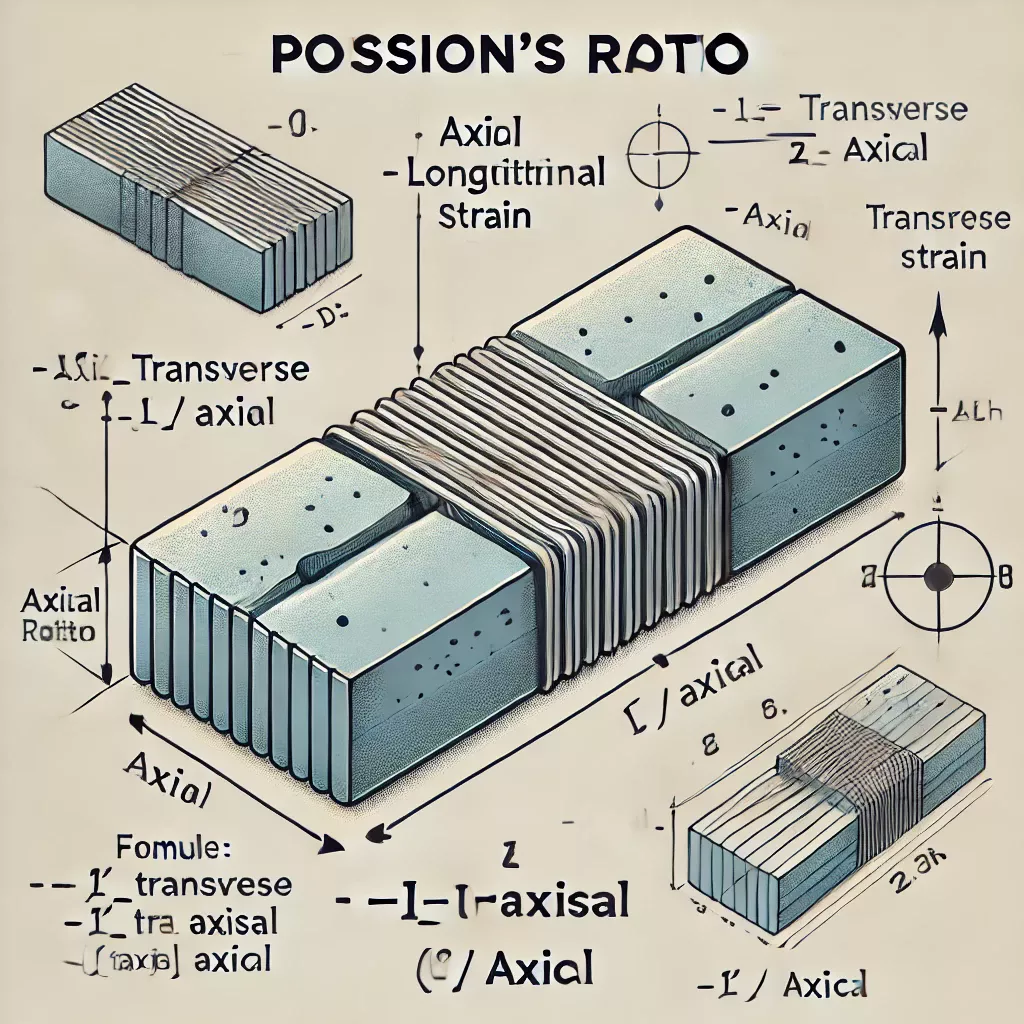
En science des matériaux, le ratio est un rapport à deux dimensions, il exprime la déformation perpendiculaire par la pression mesuré par le symbole ν (nu)) . Il est défini comme le ratio d’une augmentation de la pression infinitésimale qui a pour résultat une décroissance du volume.
Mesure noté K modulaire de la résistance du matériau à n’importe quelle pression.
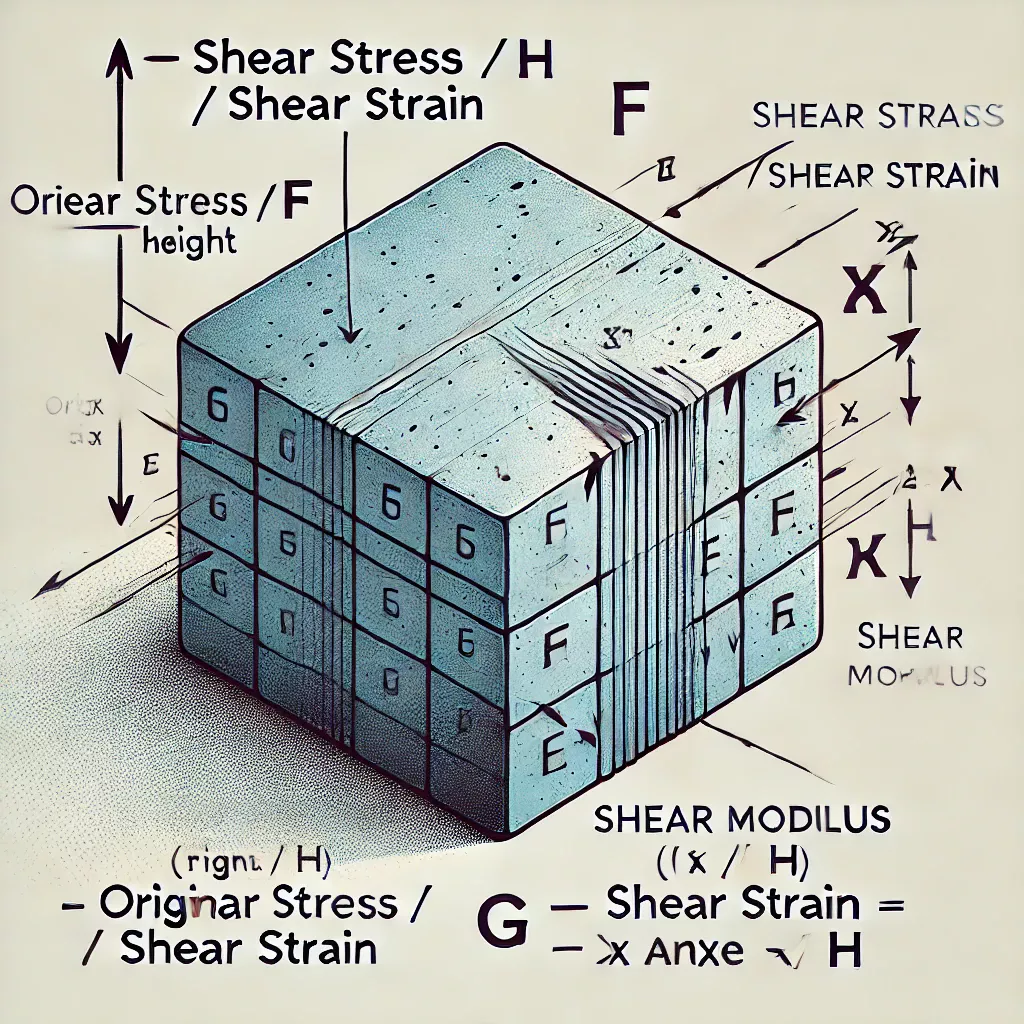
En science des matériaux, le module de cisaillement ou le module de rigidité, noté G, ou parfois S ou μ, est une mesure de la raideur élastique d’un matériau et est défini comme le rapport entre la contrainte de cisaillement et la déformation de cisaillement
Propriétés Réactives
L’électronégativité est une quantification de la force d’attraction des atomes sur les électrons qui vont participer à la liaison chimique pour se lier à d’autres atomes.
Cliquez sur le lien pour voir le tableau périodique de l’électronégativité.
L’affinité Electronique : -48.0 kJ/mol
L’affinité électronique est l’énergie libérée par un électron lors de la liaison chimique.
Radioactivité : Non
Emission d’onde radio du matériau
Demi-vie : (Aucune car pas radioactif)
Autres propriétés :
Section Efficace des Neutrons : 374 barn
En physique nucléaire la section efficace des neutrons est utilisé pour décrire l’interaction entre un neutron et une autre particule à noyau.
Barn : est une unité de mesure de surface plus petite que le femtomètre (unité la plus petite du système métrique classique 10^-15) donc très utile pour le calcul quantique.
Densité liquide :
13.534 (g/cm^3)
Echelle de Mohs : None
Dureté de Vickers : None
0.0000148213 (cm^3/mol)
Enfin je remercie mon ami russe qui a réalisé ce tableau périodique pour moi que je consulte sur mon IPHONE américain. Paix pour un monde meilleur.