Avant de s’attaquer à la chimie et à la représentation des molécules, il est nécessaire de faire un point sur ce qui est le socle de l’électronique intrinsèquement lié à cette discipline, j’ai nommé le tableau périodique.
Pourquoi ? Car pour garder des molécules neutres il est nécessaire d’avoir une équivalence électronique qui va être la balance de la charge positive protonique hormis pour les anions (-) ou les cations (+)
Je vais vous présenter plusieurs tableaux différents dont deux premiers que l’on analysera en détail pour en comprendre la structure.
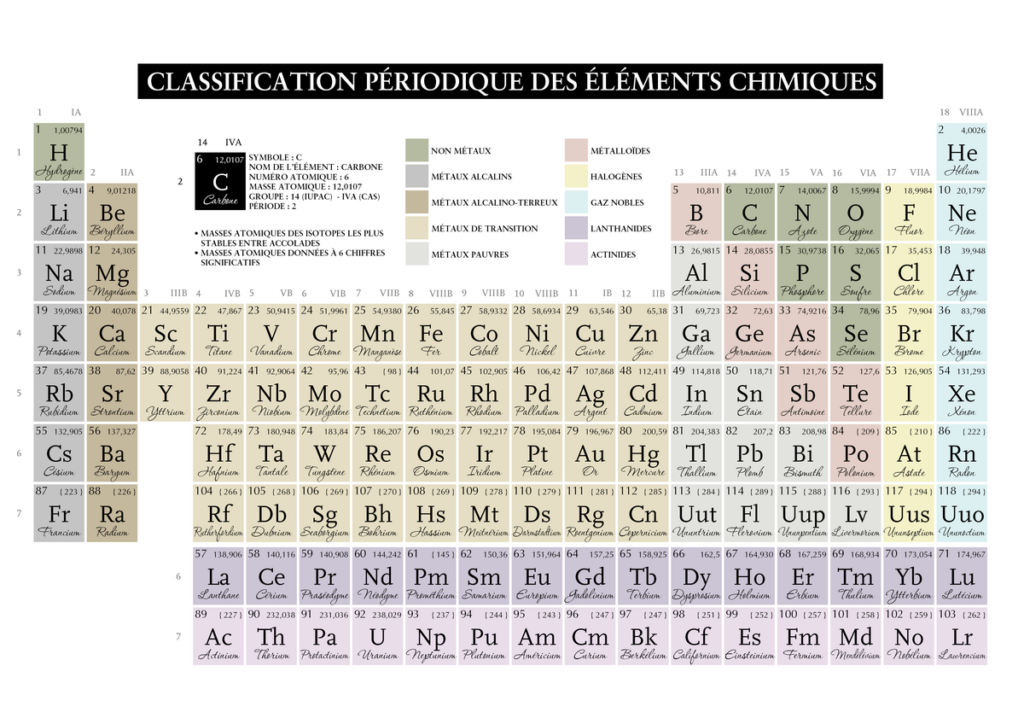
Il n’est pas si aisé de savoir lire le tableau périodique imaginé par Mendeleïev en 1869, car en fait il regorge d’informations ou encore d’interprétations.
Parlons de sa structure première, il hiérarchise les éléments en colonnes 18 qu’on appellera couches et en 7 lignes qu’on appellera périodes, qui sont en fait les périodes de révolutions des électrons (leur trajectoire orbitale sur la couche). Il présente 118 éléments en fonction de leur masse croissante par rapport à l’isotope(même nombre de protons mais pas de neutrons) du carbone 12.
Chaque élément présents sur la même couche ou colonne présentent un nombre d’électrons sur la dernière couche, dits électrons de valence. Certains de ces électrons vont participer à la liaison chimique quand deux atomes vont former une molécule.
L’Hélium qui n’en comporte que deux est l’exception qui confirme la règle.
Il faut distinguer électrons de valence, et la valence chimique, tous les électrons de valence ne participent pas à la liaison chimique donc parmi ces électrons on peut déterminer leur valence chimique, qui sont les électrons qui vont participer à la liaison chimique entre deux atomes au sein d’une molécule.
Je vais expliquer cela avec le dioxyde de carbone plus tard dans l’article.
Tout d’abord comment se lit une case du tableau périodique :

Le nombre atomique représente le nombre de protons, la lettre son appellation lorsque l’on lit une formule moléculaire. La masse soit quantité de matière figure en dessous ou en haut a droite dans un dictionnaire .
Sur certains tableaux on peut trouver l’élément sous la forme à l’état 0° avec une équivalence de pression en kPa et parfois le nombre de masse (c’est à dire le nombre de protons et de neutrons) par opposition au nombre de charges qui sont le nombre d’électrons et donc insidieusement de protons (l’atome étant neutre).
L’hydrogène à une certaine pression forme des nuages.
L’hydrogène est sur la colonne 1 donc il a un électron sur sa couche externe, c’est à dire un électron de valence.
Maintenant le tableau dans son intégralité :
A partir de la 13ème couche on note la colonne : 13-10 = 3 pour occulter les métaux dits de transition en beige dans le tableau.
Premier exemple :
Lorsque je prends le Carbone, je vois qu’il est en couche 14-10 = 4, il a donc 4 électrons sur sa couche externe(valence).
Bien mais si je veux le lier à un atome d’oxygène pour former par exemple du dioxyde de carbone. Je lis que l’oxygène est sur la couche 16 -10 = 6, il a donc 6 électrons sur sa couche externe(valence).
Comment faire pour les assembler correctement sur le plan de la molécule ? Car il n’ont pas le même nombre d’électrons qui participent à la liaison chimique.
Lorsque l’on travaille en seconde ou première, nous travaillons principalement avec 3 couches électroniques : la couche K, la couche L et la couche M.
Cette répartition en 3 couches est fondamentale pour appliquer la règle du duet(2) et de l’octet(8),
On cherche à saturer ces couches pour que la dernière d’entre elle, j’ai nommé la couche externe forme des liaisons covalentes entre différents atomes du tableau périodique pour former des composés moléculaires. Les liaisons covalentes sont aussi appelés des doublets liants : les électrons sont échangés et non transférés.
Il faut savoir que la couche K est saturé par un duet,(2) d’électrons que la couche L par un octet (8) d’électrons et que la couche M par un nombre de 18. Nous verrons qu’il existe bien d’autres couches…
Pour calculer les électrons sur la couche externe de chaque atome, on va se baser sur la composition électronique du gaz antérieur le plus proche : pour les deux atomes qui nous intéressent il s’agit de l’hélium qui n’a que deux électrons sur sa couche K(2), cela n’a donc pas d’importance pour notre calcul puisque le carbone et l’oxygène ont une couche K saturé d’un duet (2) également.
Reprenons, le carbone et l’oxygène comme on l’a vu ont 4 et 6 électrons sur leur couche
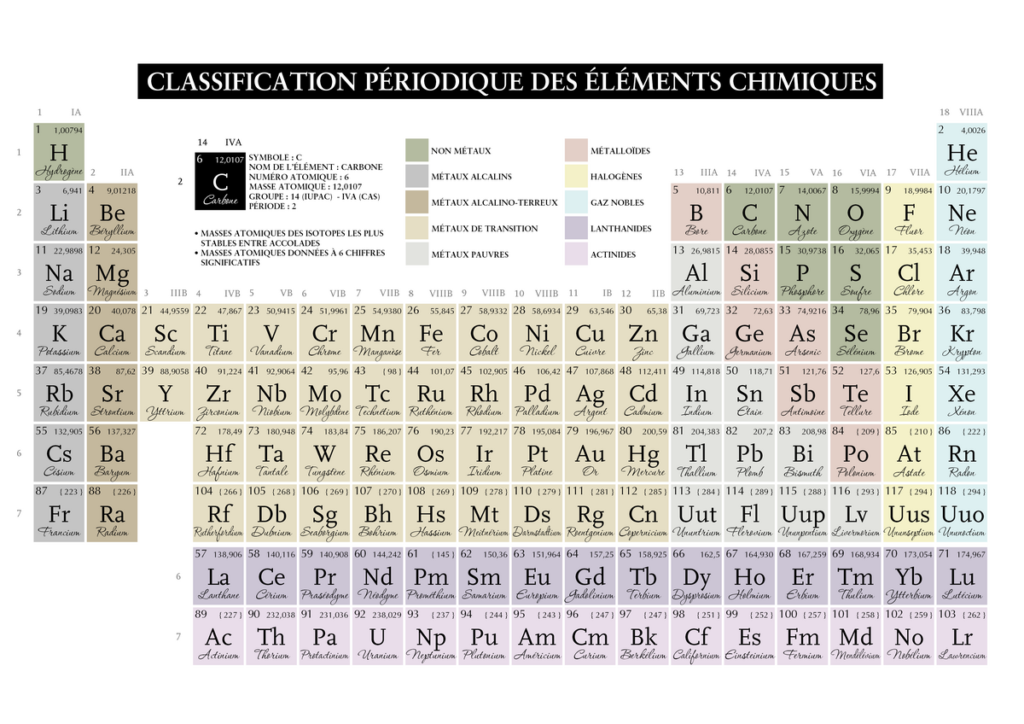
Carbone 6 : K(2) L(4)
Oxygène 8: K(2) L(6)
On a donc 6 électrons sur la couche externe pour l’oxygène et 4 électrons sur la couche externe pour le carbone externe mais l’oxygène qui veut respecter la règle de l’octet et saturer sa couche externe pour se stabiliser n’a que deux électrons qui vont participer à la liaison chimique.
Donc pour respecter l’équivalence, il nous faudra deux atomes d’oxygène puisque le carbone central a 4 électrons.
Un trait représentant deux électrons, on voit bien que chaque atome d’oxygène a deux liaisons et que le carbone en a au total 4 de par sa position centrale dans la molécule.
Tableau périodique version minéral :
Tableau périodique Applications usuelles :
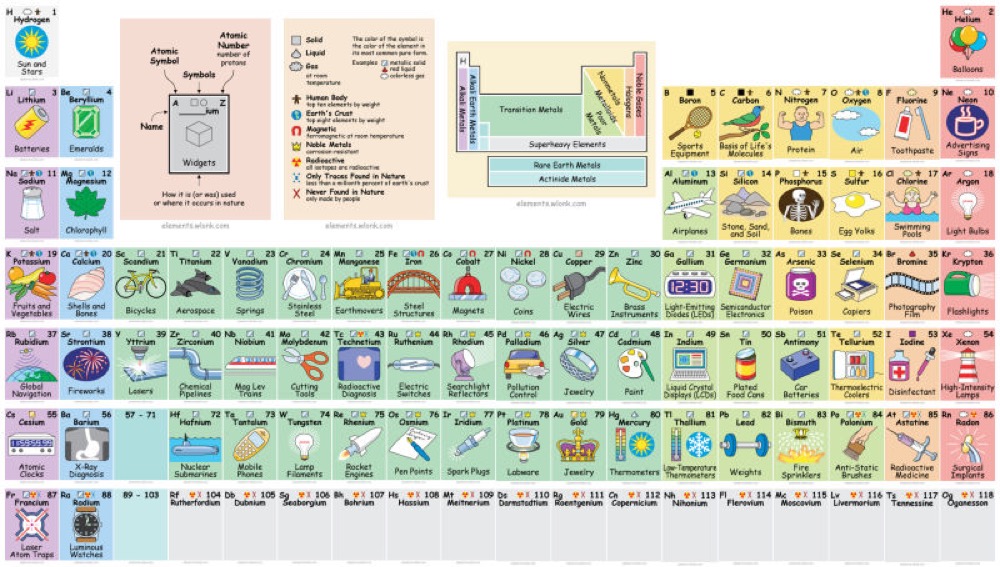
Autre utilité du tableau périodique : déterminer les ions propres à chaque atome : dits monoatomiques.
Là encore on va s’attaquer à calculer sur la base du numéro atomique soit son nombre de charges (protons, électrons)
L’atome va chercher à devenir encore plus stable ainsi il va chercher à se lier au gaz rare méta-stable le plus proche sur le tableau.
Ainsi Le fluor de nombre de charges 9 va gagner un électron en essayant de se stabiliser au néon (10) le gaz rare noble qui lui est associé ce qui va donner l’ion F-¹ .
Le chlore (17e) va gagner lui aussi gagner 1 électron en essayant de se stabiliser comme l’argon (18e) donc on aura Cl-1
Mais pourquoi le carbone n’a pas d’ion monoatomique ? Et bien c’est le propre de la chimie organique : voici une petite explication fournie par chat gpt :
https://chatgpt.com/share/687be9b9-6e00-800f-9c24-df244225c9bd
Par contre, ce qu’il faut comprendre c’est que le tableau périodique dit classique contrairement au quantique n’est pas adapté pour calculer les ions monoatomiques des métaux en transition.
Le fer a deux ions Fe2+ et Fe3+ dans ces conditions une structure avec des blocs des sous-couches, des couches, des orbitales sera plus adapté pour calculer ses ions. voir mon article sur le tableau périodique quantique.
Résumé :
Pour calculer les électrons sur la couche externe, on se base toujours sur le gaz noble antérieur. Par contre pour calculer les ions monoatomiques on se base sur le gaz stable le plus proche. Pour les métaux en transition on peut se baser sur le tableau périodique quantique et sur la fonction orbitale ce qui n’est pas possible sur le tableau périodique classique. On doit aussi remplir le tableau, l’élément selon la méthode de Kuchlowski pour déterminer la configuration électronique complète du métal en transition.
